
Van Pols tot Praktijk: Advies voor huisartsen over het beoordelen van AF-meldingen via smartwatches.
Slimme zogenaamde “smart-watches” horloges worden steeds vaker ingezet om atriumfibrillatie (AF) vroegtijdig op te sporen. [...]

Slimme zogenaamde “smart-watches” horloges worden steeds vaker ingezet om atriumfibrillatie (AF) vroegtijdig op te sporen. [...]

Hypertensieve aandoeningen tijdens zwangerschap komen voor bij ongeveer 10% van de gevallen, waarbij pre-eclampsie optreedt bij 3–4% [...]

Digitalis werd jarenlang gezien als ouderwetse cardiologie, maar nieuwe data zetten het middel opnieuw in de schijnwerpers. [...]
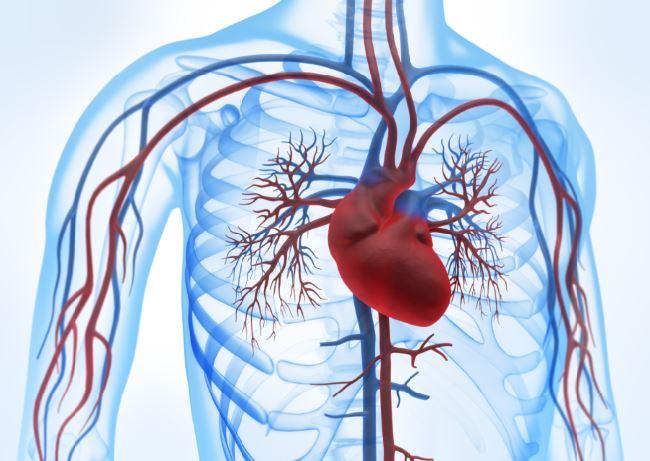
Het inschatten van iemands risico op cardiovasculaire events is voor zowel huisartsen, POH’s als cardiologen aan de orde van de dag. [...]
Cardio-oncologie richt zich op de preventie, vroege herkenning en behandeling van hart- en vaatziekten bij (ex-)patiënten met kanker. [...]

Aandacht voor fragiliteit, comorbiditeit en polyfarmacie. Een complete beoordeling van de oudere patiënt met dyspnoe. [...]

Helaas zijn hart- en vaatziekten de belangrijkste oorzaak van maternale sterfte. [...]
Als huisarts en als cardioloog zien we regelmatig volwassen patiënten met een verdikte hartspier of linker ventrikelhypertrofie. [...]